製造業における製品品質の保証は、検査規格書と検査基準書の精緻な作成から始まります。この記事では、これらの文書が製品開発のどの段階で、どのように取り組まれるべきかを解説します。
設計から生産準備まで、品質を形作るプロセスについても見ていきましょう!

品質マネジメントシステム普及の応援が目的のサイトです!「難解な規格を簡単に解説」をモットーに、「ちょっと相談したい」ときに頼りになるコンサルタントを目指しています!まずはお気軽にご連絡ください★
「無料で学ぶ」「有料で実践する」——皆様の目的に合わせて活用可能です!
✅ QMS・品質管理・製造ノウハウを無料で学びたい方へ
👉 本サイト「QMS学習支援サイト」を活用しましょう!「QMSについて知りたい」「品質管理の基礎を学びたい」方に最適!
✔ IATF 16949やISO 9001・VDA6.3の基礎を学ぶ
✔ 品質管理や製造ノウハウを無料で読む
✔ 実務に役立つ情報を定期的にチェック
✅ 実践的なツールやサポートが欲しい方へ
👉 姉妹サイト「QMS認証パートナー」では、実務で使える有料のサポートサービスを提供!「すぐに使える資料が欲しい」「専門家のサポートが必要」な方に最適!
✔ コンサルティングで具体的な課題を解決
✔ すぐに使える帳票や規定のサンプルを購入
✔ より実践的な学習教材でスキルアップ
皆様の目的に合わせて活用可能です!
| ・当サイトの内容は、あくまでもコンサルタントとして経験による見解です。そのため、保証するものではございません。 ・各規格の原文はありません。また、規格番号や題目なども当社の解釈です。 ・各規格については、規格公式サイトを必ず確認してください。 ・メールコンサルティングは空きあります(2025年9月現在)。この機会に「ちょっと相談」してみませんか?1質問の無料サービス期間を是非ご利用ください。 →サービスのお問い合わせはこちら |
2025年:新企画始動告知!
メールコンサルティング初回契約:初月50%以上割引★
サービス詳細はこちら
・オンラインコンサル/現地コンサルの空き状況について
【現在の空き状況:2025年9月現在】
・平日:6時間以上ご利用で月1回のみ空きあり
・夜間:19:30-21:00でご相談承ります
・土日:少々空きあります
オンライン会議システムを利用したコンサル詳細はこちら
ISO9001の構築・運用のコツは「規格の理解」と「ルールと記録の構築」の2つがカギ!教材とサンプルを利用しつつ、相談しながら低コストで対応可能なノウハウをご提供いたします!
【ISO9001:おすすめ教材】
| 👑 | 教材No. | タイトル:詳細はこちら |
| 1 | No.3-001 | ISO9001学習支援教材 |
| 2 | No.9121 | 顧客満足度調査表 |
| 3 | No.72-1 | 個人の力量と目標管理シート |
○:お振込・クレジットカード払いが可能です。
○:請求書・領収書の発行は簡単ダウンロード!
→インボイス制度に基づく適格請求書発行事業者の登録番号も記載しています。
○:お得なキャンペーン情報などは本記事トップをご確認ください。
この記事の目次
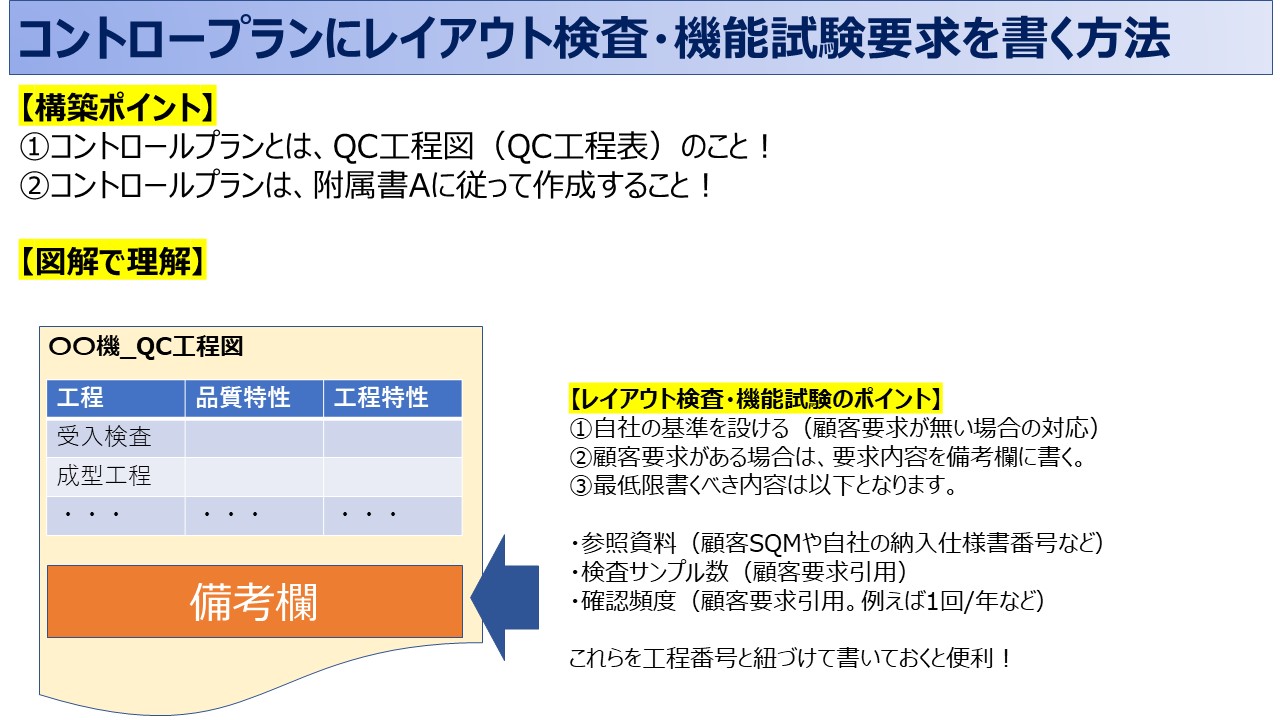
製造業でよく使う「検査規格書」とは何?

検査規格書とは、製造業で製品の品質を保証するために設定される基準や条件を明記した文書です。これには製品や部品が満たすべき品質基準、検査方法、合格基準などが詳細に記されています。
管理項目としては、寸法、材質、強度などが挙げられ、検査基準には許容誤差や性能指標が定められており、検査規格書の決め方は、製品の用途、顧客の要求、業界標準、法規制などを考慮して、各企業やプロジェクト固有の条件に合わせて策定されます。
この文書は製造プロセスの各段階で品質を管理・保証し、製品が一貫した品質で顧客に提供されることを確実にするために不可欠です。
おすすめ記事
検査規格書と検査基準書の違いは何?

検査規格書と検査基準書は、しばしば混同されがちですが、その目的と内容において重要な違いがあります。
検査規格書
検査規格書は、製品や部品が満たすべき具体的な品質要件や特性を定義する文書です。
これには、製品の寸法、形状、材質、性能などの詳細な仕様が含まれ、製品設計の意図を反映しています。また、製品がこれらの規格を満たしているかを判断するための詳細な検査方法や手順も記載されています。
検査基準書
一方、検査基準書は、製品検査のプロセス自体に焦点を当てた文書で、どのようにして製品が検査され、品質が評価されるべきかについての指針を提供するためのものです。
これには、検査に使用される具体的なツールや機器、検査を行う条件、検査員の資格、検査頻度、データ記録の方法など、検査プロセス全体の管理項目が含まれます。
要するに、検査規格書は「何を検査するか」に焦点を当て、製品の品質要件を定めるものであり、検査基準書は「どのように検査を行うか」に焦点を当て、検査プロセスの実施方法を規定するものです。
両者は製品品質を保証するために相互に関連しながらも、その目的と内容において異なります。
おすすめ記事
検査の管理項目の決定方法のコツとは?

検査の管理項目を決定する際のコツは、製品の品質と安全性を確保しながら、効率的かつ実効性のある検査プロセスを設計することです。
以下に、管理項目の決定方法のコツをいくつか挙げます。
製品仕様の徹底理解
検査の管理項目を決定する際には、まず製品の設計仕様、性能要件、使用される材料を深く理解することが不可欠です。
製品の設計仕様には、その製品がどのように機能するべきか、どのような状況で使用されるかといった詳細な情報が含まれています。この理解を深めることで、製品の品質に最も大きな影響を与える要素を特定することができ、重要な管理項目を見極める基盤が築かれます。
また、材料の特性や組み合わせによる影響も考慮に入れることで、製品が求める性能を維持するために必要な検査項目を精査できます。
結果として、製品の品質や信頼性を確保するための効果的な検査プロセスを設計することが可能になります。
重要品質特性の識別
製品における全ての特性が同等に重要であるとは限りません。顧客の要求や製品の安全性、そしてその機能性に最も影響を与える特性を優先的に管理することが求められます。
これらの重要品質特性を識別し、それを基に検査の管理項目を決定することで、効率的かつ効果的な品質管理が実現します。
例えば、製品の特定部分の精度や強度が使用に際して特に重要である場合、その部分に関する検査項目を厳格に設定することが必要です。
このように、特に重要な特性を優先して管理することで、限られたリソースを最も効果的に活用し、製品全体の品質向上を図ることができます。
・面談不要、メールだけで完結
・初回は、1質問無料!納得してからご利用可能です
・月額プラン(サブスク形式)なら自動更新!何度でも安心相談可能!
リスクベースのアプローチ

管理項目を決定する際には、リスクベースのアプローチが非常に有効です。潜在的なリスクや失敗モードを事前に評価し、それが製品の品質にどのような影響を与えるかを慎重に検討します。
例えば、FMEA(故障モード影響分析)などのリスク評価ツールを活用することで、どの部分が最もリスクが高いか、どのような対策が必要かを明確にすることができます。このアプローチにより、最も重大なリスクに対して効果的な管理項目を設定し、品質に対する潜在的な影響を最小限に抑えることが可能になります。
結果として、製品の信頼性や安全性を確保し、顧客満足度を向上させるための重要な手段となります。
関連記事
業界標準と規制要件の遵守
製品が対象とする市場における業界標準や法規制要件を把握し、それに準拠した管理項目を設定することは非常に重要です。これにより、製品が市場での競争力を維持し、法的なトラブルを回避することができます。
たとえば、特定の業界においては、安全性や環境への配慮に関する規制が厳しく設けられていることが多く、これらに違反しないためにも、該当する規制を確実に理解し、それに基づいた検査項目を設ける必要があります。
業界標準に準拠することは、顧客に対する信頼の獲得にもつながり、製品の市場価値を高める要素となります。
過去のデータと経験の活用
過去の製品不具合データや顧客からのフィードバック、製造プロセスの監視データを活用することで、重要な管理項目を特定することができます。これらのデータを分析することで、過去に問題が発生しやすかった箇所や顧客からの苦情が多かったポイントを明確にし、それに基づいて管理項目を設定することが可能です。
たとえば、過去のデータから特定の部品の品質に問題があったことがわかれば、その部品に対する検査項目を強化することができます。
このように、経験とデータを活用することで、再発防止策としての検査管理がより効果的に機能し、製品の品質向上に寄与します。
ステークホルダーとの協働
管理項目の選定には、設計者、製造技術者、品質保証チーム、さらには顧客との協働が欠かせません。これらのステークホルダーの知識と経験を活かし、実際の使用状況や製造現場での課題を踏まえて検査項目を決定することが重要です。
ステークホルダーとの連携により、製品に関する多角的な視点を取り入れることができ、より実効性のある検査項目が設定できます。また、顧客との協働は、顧客の期待に沿った製品品質の維持や向上にも寄与し、顧客満足度の向上にもつながります。
適切なコミュニケーションを通じて、効果的な管理項目の設定を目指しましょう。
関連記事
継続的な改善とレビュー

検査の管理項目は静的なものではなく、製品の変更やプロセスの改善、新たな顧客要求の発生などに応じて、定期的な見直しと更新が必要です。継続的な改善とレビューを行うことで、常に最新の状況に対応した効果的な管理項目を維持することができます。
例えば、新しい材料や技術が導入された場合や市場の要求が変化した場合には、それに応じて検査項目を見直すことが求められます。
このプロセスを繰り返すことで、検査プロセスの実効性が高まり、製品品質の向上を継続的に実現することが可能になります。
・面談不要、メールだけで完結
・初回は、1質問無料!納得してからご利用可能です
・月額プラン(サブスク形式)なら自動更新!何度でも安心相談可能!
検査規格書と検査基準書はどの段階で作るべき?
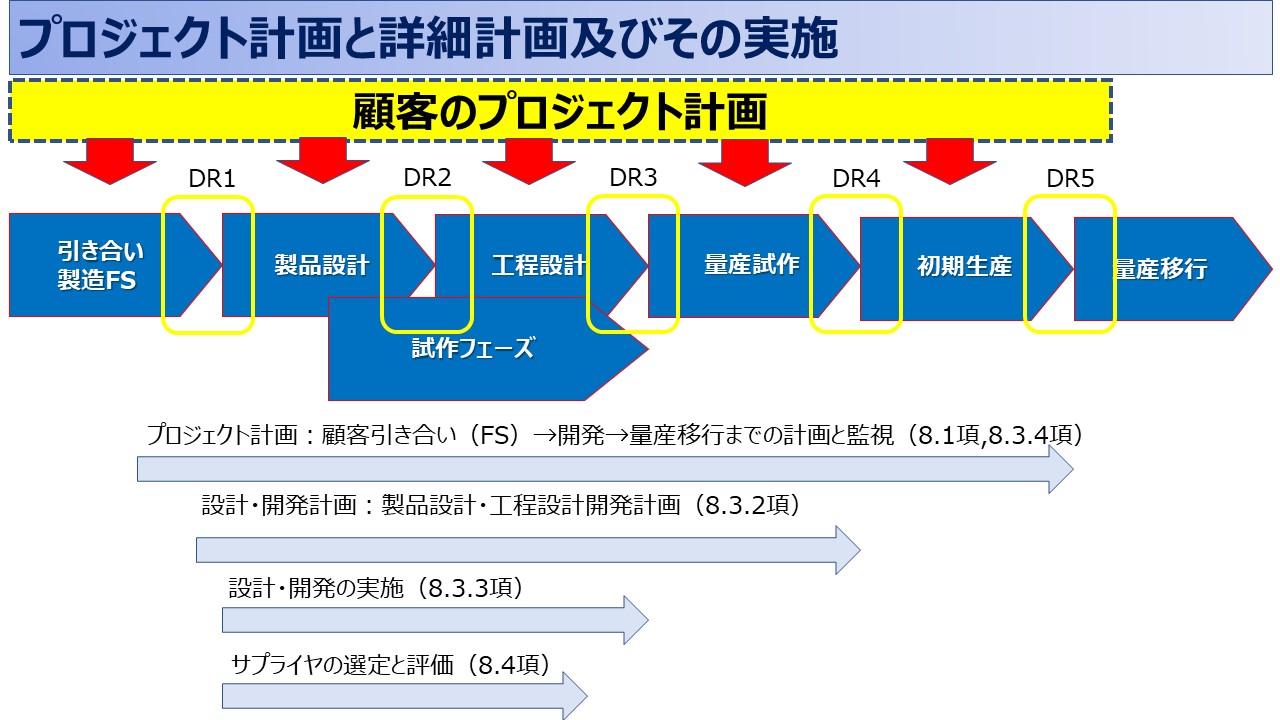
検査規格書と検査基準書の作成は、製品開発プロセスのデザインレビューの異なる段階で行うべきです。これらの文書は製品の品質保証に不可欠なものであり、設計の初期段階から関与していることが重要です。
以下は、一般的なガイドラインとなります。
- 概念設計レビュー(Conceptual Design Review):
- この初期段階では、製品の概念と初期設計が確立されます。ここでは、主要な機能要件と性能指標が議論され、検査規格書の初期の概念が形成され始めることがあります。この段階での文書は非常に基本的であり、設計が進むにつれて詳細化されます。
- 詳細設計レビュー(Detailed Design Review):
- 詳細設計段階では、製品の具体的な仕様、部品、およびアセンブリが定義されます。この段階で検査規格書を作成することが理想的です。製品設計が詳細に固まり、検査でカバーする必要がある特定の要件や特性が明確になるため、製品が設計仕様を満たしていることを確認するための具体的な基準と方法を文書化できます。
- プロトタイプレビュー(Prototype Review):
- プロトタイプレビュー段階では、実際の製品サンプルが評価され、機能と性能がテストされます。この段階で検査基準書を詳細化し、完成したプロトタイプを使用して検査プロセスを検証することが重要です。検査方法、ツール、頻度などが実際の製品に基づいて調整され、最終的に確定されます。
- 生産準備レビュー(Production Readiness Review):
- 製品が量産に移行する前の最終段階です。この時点で、検査規格書と検査基準書は最終的な形をとり、生産ラインでの使用に適したものでなければなりません。製造プロセスと品質保証プロセスが整合していることを確認し、必要に応じて最終調整を行います。
デザインレビューの各段階でこれらの文書を作成および更新することで、製品設計が品質基準を満たし、市場での成功につながる製品の生産が可能になります。
検査規格書・検査基準書:まとめ

製品の品質は、設計の初期段階からの細心の注意と計画にかかっています。検査規格書と検査基準書は、デザインレビューの異なる段階で適切に作成・更新されるべき重要な文書です。
詳細設計で検査規格を定め、プロトタイプ検証で検査基準を精密化し、生産準備で最終確認を行いましょう。このプロセスを通じて、あなたの製品は市場での成功を収めるための強固な基盤を築くことができます。
品質へのこだわりが、最終的な製品の価値を高め、顧客満足を実現する鍵です。
・教材(電子書籍)の教育教材
・規定類・帳票類のサンプルによる自力構築支援
・メールコンサルティング
最終的には「自社で回せる品質マネジメントシステム」を目指して、継続的な改善・運用が可能な体制の構築を目指します!